目前,靶向、免疫或靶向联合免疫均已进入晚期肾癌的一线治疗推荐,且主要根据IMDC危险分层等进行分类。选择靶向、免疫以及靶向联合免疫,无异于选择前后走还是并排走。2020年ESMO大会上,CheckMate 9ER研究评价了纳武利尤单抗联合“全能靶向药”卡博替尼的联合策略,而BIONIKK研究则探索了一种基于生物学特征的免疫或TKI治疗策略。两项研究将带给临床怎样的启示?北京大学肿瘤医院盛锡楠教授分享如下。
研究简介
Nivolumab联合卡博替尼与舒尼替尼单药作为晚期肾细胞癌一线治疗方案的效果比较:Ⅲ期CheckMate 9ER随机试验的初步结果
背景:CheckMate 9ER试验评估了检查点抑制剂(CPI)nivolumab(N)联合酪氨酸激酶抑制剂(TKI)卡博替尼(C)与舒尼替尼(S)单药作为晚期透明细胞肾细胞癌(aRCC)一线治疗的效果。作为单药,N和C在aRCC的治疗中均表现出良好的疗效与安全性。同时C具有免疫调节特性,可对抗肿瘤诱导的免疫抑制,这为N+C的联合用药提供了依据。
方法:患者按IMDC风险评分、肿瘤PD-L1表达以及肿瘤位置1:1随机分为2组。第一组每2周静脉注射N 240 mg 联合每日口服C 40 mg另一组以6周为一个周期,其中前四周每日口服S 50 mg,后两周停药。两组用药直至患者疾病进展或出现不可接受的毒性反应。使用N治疗的最长时限不超过2年。研究的主要终点为盲法独立中心评价(BICR)的无进展生存期(PFS)。次要终点为总生存期(OS)、BICR的客观缓解率(ORR)以及安全性评价。
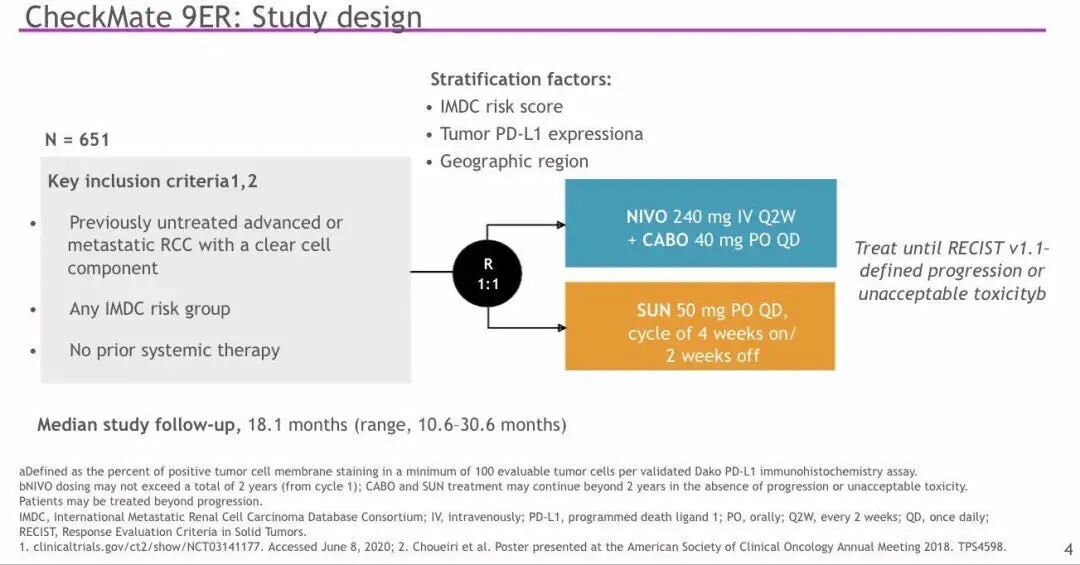 ▲CheckMate 9ER研究设计
▲CheckMate 9ER研究设计
结果:研究共纳入651名患者,通过随机分组,323名患者被分至N + C组,其余328名患者被分至S组。在这些患者中,低风险患者占22.6%,中等风险57.6%,高风险为19.7%;此外 PD-L1 _1%为24.9%。本研究的中位随访时间为18.1个月(最低10.6个月)。研究数据显示N + C与S相比可显着改善PFS(HR 0.51,P<0.0001;16.6 vs 8.3 个月)和OS(HR 0.60;P<0.001;中位时间尚未观察到)。按IMDC风险以及PD-L1分层,结果与上述一致。N + C与S相比,其ORR更高(55.7% vs 27.1%;P<0.0001)。与此同时,N+C组8.0%以及S组4.6%的患者实现了完全缓解 。N + C与S的中位反应持续时间分别为20.2 和11.5个月。并且分别有96.6%和93.1%的患者出现了不良反应事件(60.6% vs 50.9%;3级)。N + C 组出现 1例与治疗相关的死亡,而S组发生2例。TRAE导致S停药的患者占8.8%,N或C停药占15.3%,其中N + C停药3.1%,N停药5.6%,C停药6.6%。
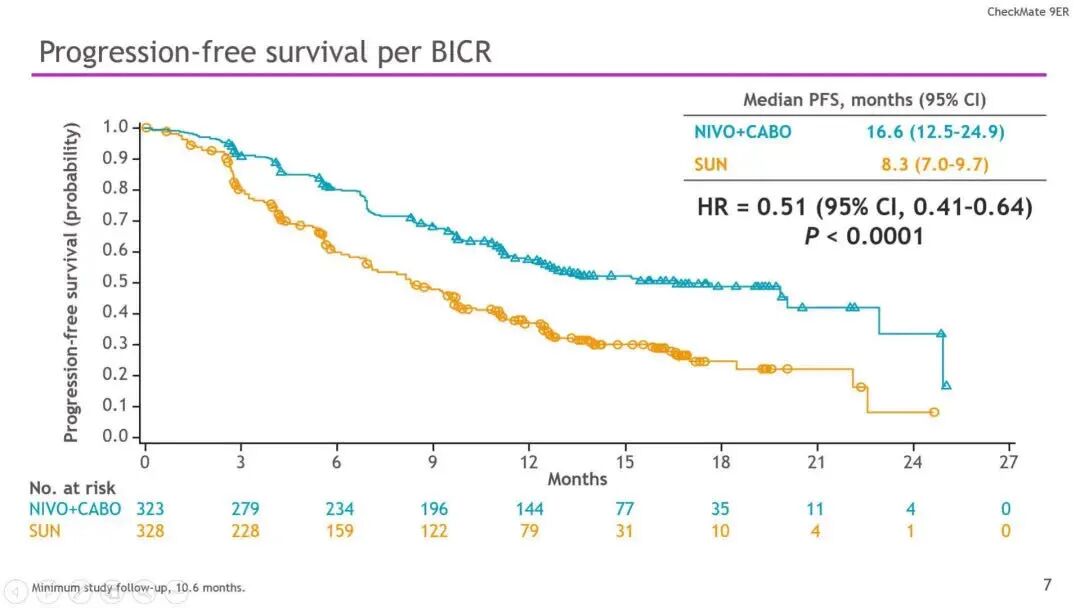 ▲BICR评估的无进展生存
▲BICR评估的无进展生存
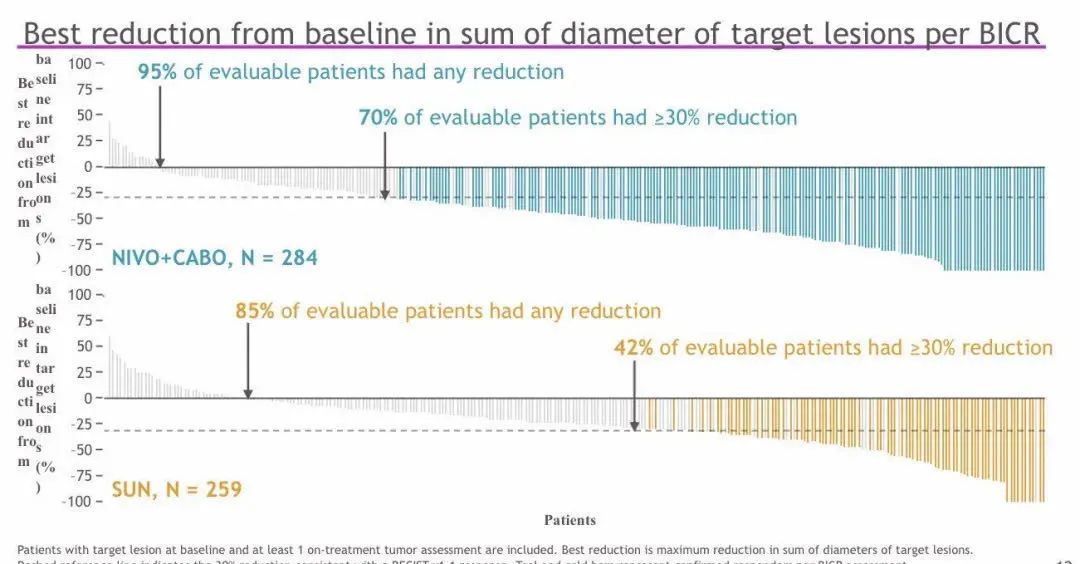
结论:在转移性肾透明细胞癌的一线治疗中,nivolumab 联合卡博替尼(N+C)的PFS、OS和ORR均优于单用舒尼替尼。且N+C联合用药安全可控,不良反应(AE)与已知的N和C单药AE谱一致。本研究结果支持N+C作为一种新的CPI+TKI选择,用于转移性肾透明细胞癌患者的治疗。
CheckMate 9ER临床研究是一项将Nivolumab联合卡博替尼且用舒尼替尼作为对照用于晚期肾透明细胞癌一线治疗的随机Ⅲ期临床研究。截至目前为止包括CheckMate 9ER在内,共有五项晚期肾癌的免疫联合治疗研究,均取得了阳性结果。其结果均优于对照组舒尼替尼靶向治疗。从去年KEYNOTE-426研究结果公布后,免疫联合治疗已经逐渐作为晚期肾透明细胞癌一线治疗推荐。今年CheckMate 9ER研究进一步奠定了免疫联合在晚期肾癌的一线治疗的地位。从目前的报道来看,Nivolumab联合卡博替尼可显著延长无进展生存时间(PFS)。且其中位生存时间达到了16.6个月。而对照舒尼替尼则为8.3个月。
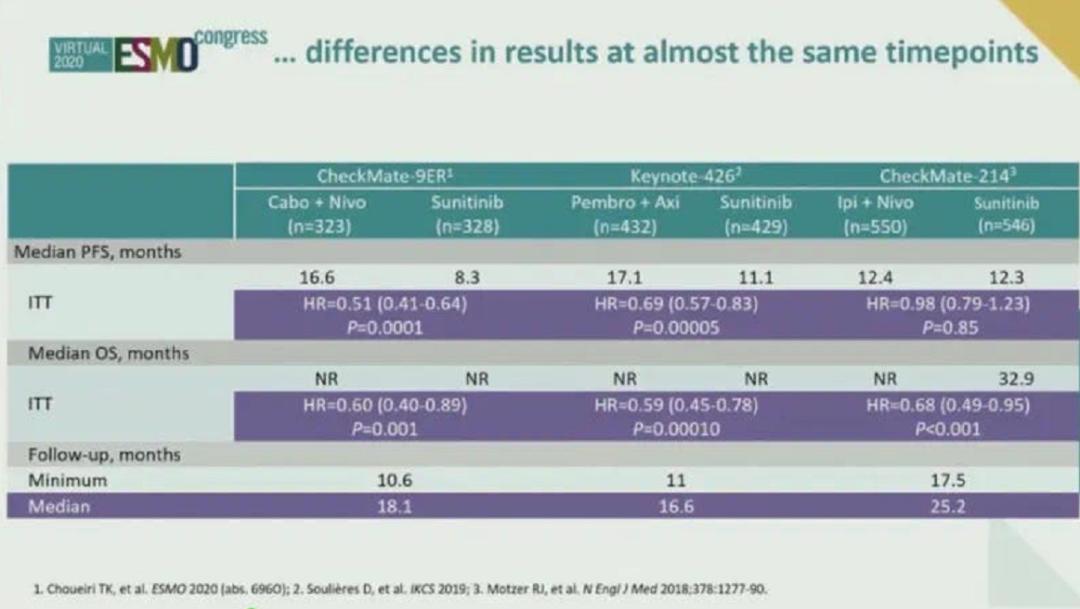 ▲几项免疫联合治疗的研究汇总(非头对头)
▲几项免疫联合治疗的研究汇总(非头对头)
在亚组分析当中,中高危的人群获益更明显。随着危险程度的升高,获益愈加明显。这与我国今年推出的CSCO肾癌诊疗指南2020版的思路是一样的。CheckMate 9ER研究与其他的临床研究相比,研究设计并无特殊之处,虽然纳武单抗首先获得晚期肾癌治疗适应症,但与靶向药物联合研究滞后于其他免疫检查点抑制剂,卡博替尼也是一个具有一级循证医学推荐的晚期肾癌二线药物。这两个药物进行联合,其取得的结果与以往研究类似。并且其中位PFS时间为16.6个月,是目前所有Ⅲ期临床研究中PFS时间是最长的。其客观缓解率为55.7%,绝对数值可能比KEYNOTE-426研究要略低一些,但其中完全缓解的病人的比例与KEYNOTE-426研究基本一致。既往研究中卡博替尼已被证实在治疗肾癌骨转移病人方面具有一定优势。在本研究中,与无骨转移病人相比,肾癌合并骨转移的病人选择Nivolumab联合卡博替尼,获益更大。所以今后对于肾癌合并骨转移的患者可以进行优先推荐。
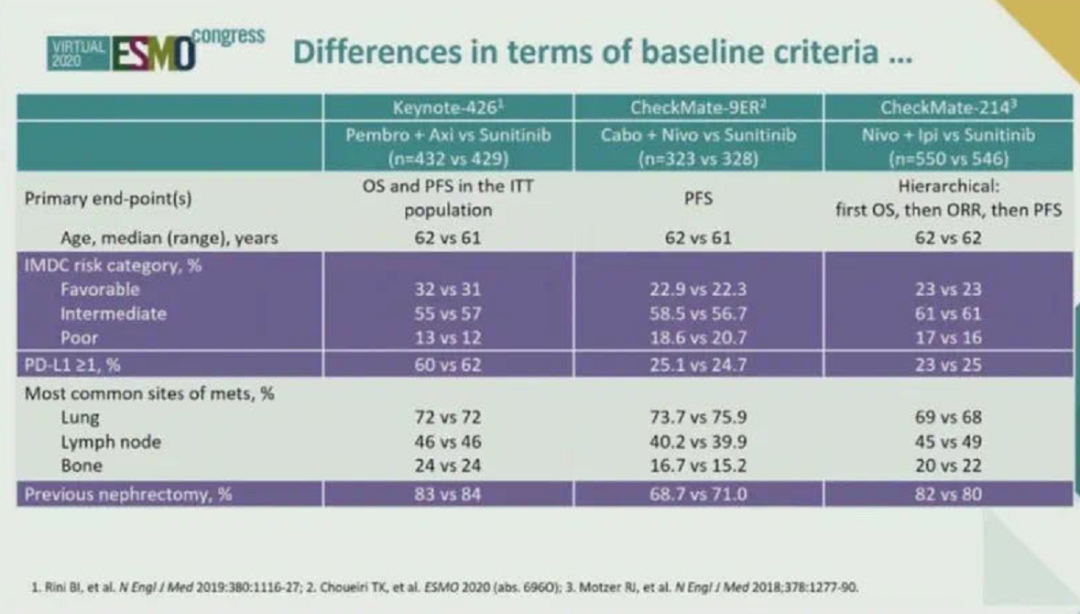 ▲几项免疫联合治疗研究的亚组分析(非头对头)
▲几项免疫联合治疗研究的亚组分析(非头对头)
对于晚期肾癌患者,其治疗方式的选择目前仍依赖于危险分层。也就是说对于中高危的病人,要优先考虑免疫联合治疗;但对于低危的病人,其可能从免疫联合治疗中获益并不显著,推荐选择靶向药物进行治疗。
应用nivolumab(N)和ipilimumab或VEGFR酪氨酸激酶抑制剂(TKI)治疗初发转移性肾癌(m-ccRCC)的Ⅱ期生物标志物驱动性试验结果:BIONIKK试验
背景:Nivolumab-ipilimumab(NI)和舒尼替尼/帕唑帕尼(TKI)分别适用于m-ccRCC患者IMDC中/高分线和低风险组。基于对m-ccRCC基因表达的无监督分析,研究发现了4组(ccrcc1-4)其具有不同的免疫及血管生成特性,这有利于更好地识别N、NI或TKI的应答者。本研究将报告BIONIKK试验的最终分析结果。
方法:BIONIKK是法国的一项多中心Ⅱ期随机试验,根据ccrcc1-4将肾癌患者分组(35个基因专属特征,CITsig)评估m-ccRCC的N vs. NI vs. TKI的治疗效果。ccrcc1,4的患者随机接受N或者NI治疗,而ccrcc2,3分别随机接受NI 或者 TKI治疗。研究的主要终点(PE)为每种治疗以及每组的客观缓解率(ORR,RECIST1.1)。次要终点为无进展生存期(PFS)、总生存期(OS)和患者的耐受性。目标队列(TC)中预计纳入150名患者。纳入一个额外的队列来评估队列间的差异性。
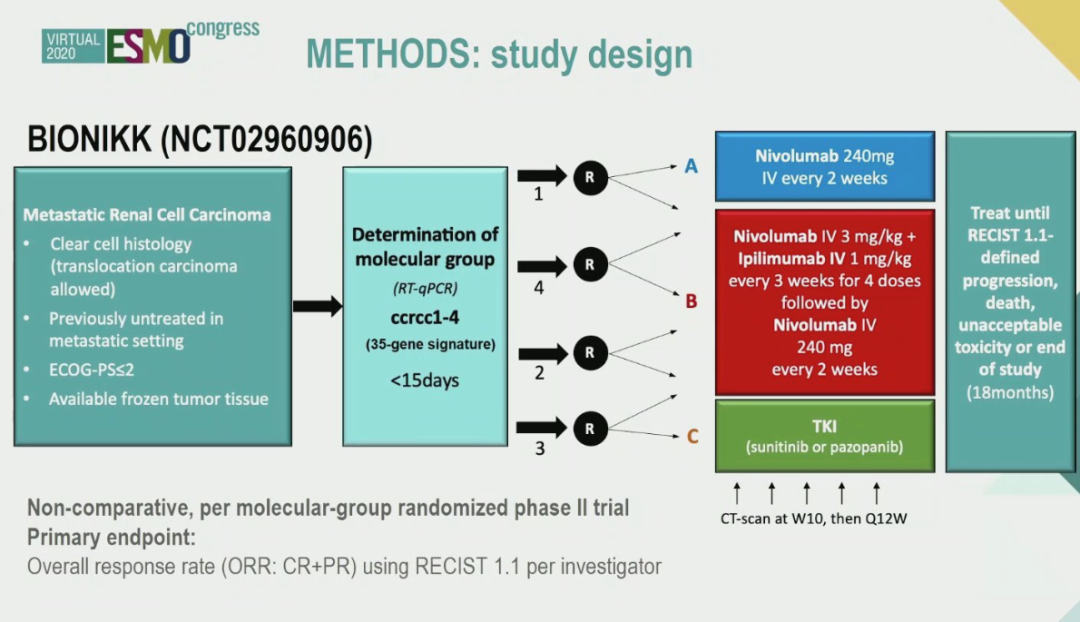 ▲BIONIKK研究设计
▲BIONIKK研究设计
结果:从2017年06月至2019年07月共筛选308人,其中随机分配接受治疗202人(ALL),可用于评价主要终点(PE)的患者有187人,目标队列(TC)共有154人。研究结果显示ccrcc1-4与IMDC风险分层之间无显著相关性(P=0.14)。各治疗药物的ORR(TC)分别为N=30%,NI=44%,TKI=50%。按ccrcc1-4分组,ORR存在差异。NI的ORR在所有组别中具有可比性。在ccrcc1中,N的ORR是NI的一半,而在ccrcc4中两者相当。在ccrcc2中,TKI的ORR与NI一样高。研究的中位随访时间为16个月,mPFS(TC)在各药物中分别为N=4.9个月,NI=10.4个月,TKI=NR。根据ccrcc1-4分组其结果同样具有差异性。目前OS数据尚不成熟。与已公布的数据相比,没有出现新的不良事件。
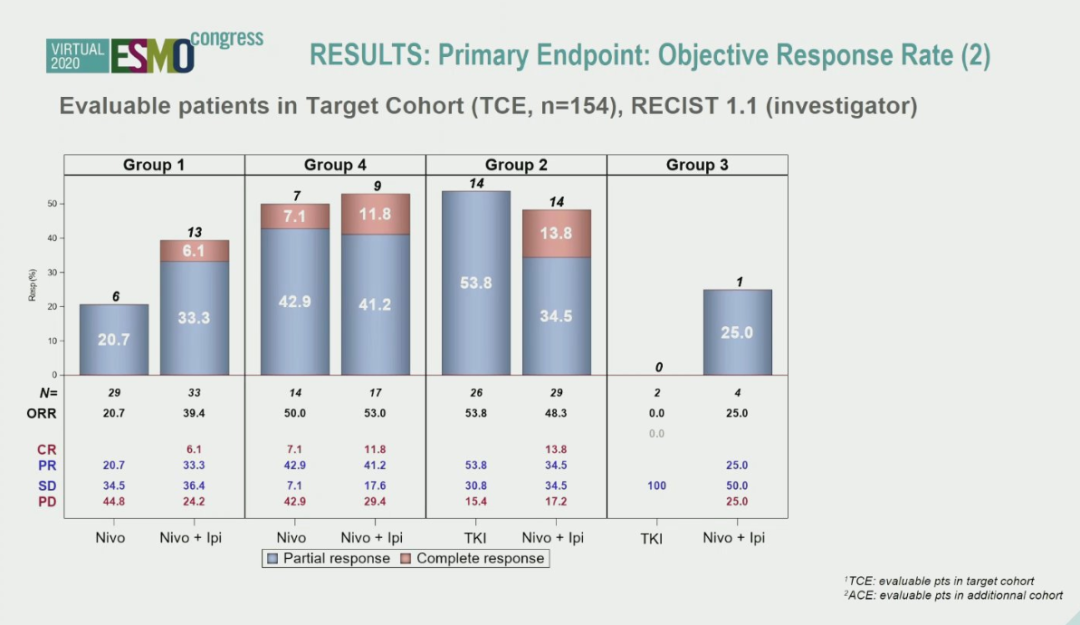 ▲主要终点ORR结果
▲主要终点ORR结果
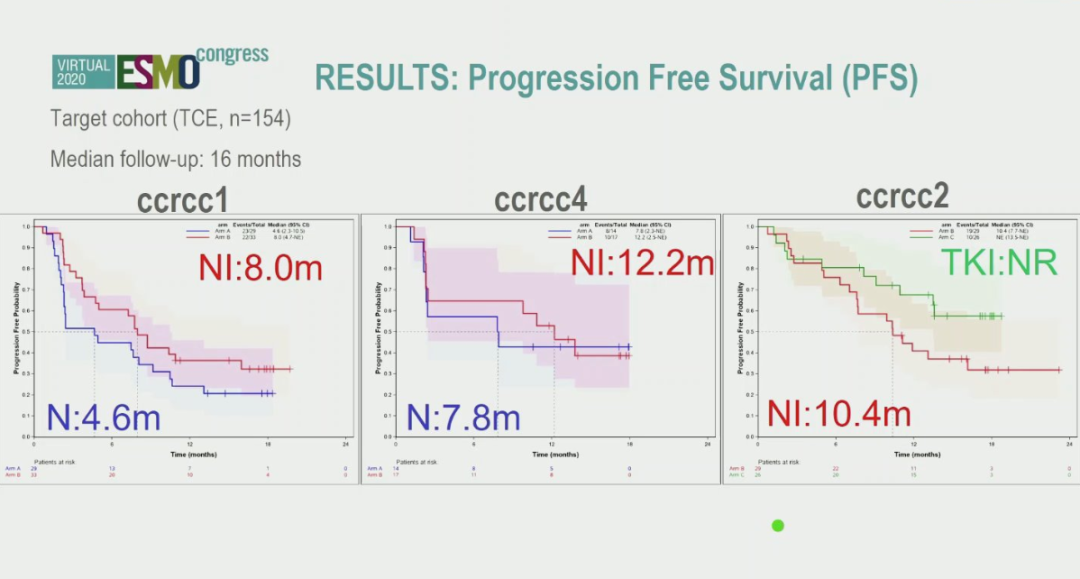 ▲次要终点PFS结果
▲次要终点PFS结果
结论:本研究首次在m-ccRCC患者中证明,基因表达特征可以提高药物治疗的反应率。因此后续将开展大型的转化项目,来筛选新的生物标志物。
BIONIKK是一项多中心Ⅱ期随机试验,入组的患者主要是晚期肾透明细胞癌。在治疗前,需要获得相应的组织标本,根据其组织学特性分为ccrcc1-4,共4个亚群。其分类依据的是2015年一项关于舒尼替尼回顾性分析研究中有关免疫微环境的研究结果。
第一亚群人群的主要特点是免疫反应及应答比较弱。第二亚群为富血供的肿瘤,可选择TKI或者TKI联合双免疫治疗。第三类就是所谓的正常分型,是正常肿瘤组织人群。第4亚群是高免疫应答人群。根据上述分类依据,将肾癌患者进行筛选,后进行随机分组治疗。以期寻找到对于免疫治疗敏感的免疫微环境分型,使患者在接受免疫治疗过程中最大程度获益。
本研究将免疫高反应性ccrcc-4亚群患者随机分组,其中一组使用Nivolumab治疗,而另一组则应用Nivolumab联合ipilimumab(NI)双免疫治疗。而对于ccrcc-1亚群,患者的免疫应答比较弱,其用药方案同ccrcc-4。对于富血供肿瘤ccrcc-2和正常肿瘤类型ccrcc-3的患者亚群,一组应用TKI,而另一组应用双免疫治疗。研究的主要思路是富血供的瘤种应用TKI,免疫微环境提示有免疫细胞浸润的,则给与免疫单药或者双免疫治疗。
从研究结果来看,对于ccrcc-2亚群患者,TKI治疗所获得的客观缓解率(54% vs 48%)及中位PFS时间都要明显优于NI治疗。对于ccrcc-4亚群患者,对免疫治疗的高反应性使其也获得了较高的的客观缓解率(ORR)。无论是选择Nivolumab还是选择Nivolumab联合ipilimumab(NI)双免疫治疗,其所获得的客观缓解率都是在50%左右。对于ccrcc-1亚群,其单药的ORR仅为21%,而双免疫治疗则可以达到39%,但结果相较ccrcc-4差。因此对于晚期肾癌患者,通过组织学筛选,如果肿瘤富血供,则选择TKI靶向治疗患者获益最大。对于血供不丰富的肿瘤,如其对免疫反应较高,应用单药免疫或者双药免疫治疗均会取得不错的疗效;如其免疫反应较差,其预后总体来说最差。
此研究的研究结果从另一个角度再次验证了IMmotion151研究结果,如果肿瘤富血供,我们发现抗血管生成靶向治疗与免疫联合靶向治疗的疗效相当。倾向于单用抗血管靶向药物。但如果肿瘤血供不丰富,研究结果则发现免疫联合要比单用靶向效果要更好。而富血供肿瘤人群,更多的是低危的人群。
但在实际临床工作中,这些biomarker很难直接转化为临床医生使用的工具。标记物的筛选多比较复杂,不如临床常用的IMDC危险分层通俗直白。后续如可以将biomarker简化,简单做成一个panel来进行人群的筛选,选择适合抗血管或者免疫治疗的人群,将对临床产生重要意义。
此外,本研究还有一个很重要的缺陷,其所选择的治疗要么是靶向药物,要么是单药,并未纳入免疫联合抗血管靶向治疗。如果将免疫联合抗血管靶向治疗引入研究,可能对临床实践影响更大一些。期待后续进一步深入研究。
医学博士,副主任医师,硕士生导师
北京大学肿瘤医院肾癌黑色素瘤内科副主任
中国临床肿瘤学会尿路上皮癌专家委员会常委
中国临床肿瘤学会肾癌专家委员会秘书
中国临床肿瘤学会青年委员
中国抗癌协会青年理事会常务理事
中国抗癌协会泌尿男生殖系肿瘤专业委员会青委
中华医学会泌尿外科分会青委会肿瘤学组成员
北京抗癌协会泌尿肿瘤专业委员会青委会主任委员
《CSCO肾癌诊治指南2019版》执笔人
主要从事肾癌、膀胱癌、前列腺癌等泌尿肿瘤以及恶性黑色素瘤的内科治疗,研究方向为泌尿肿瘤与黑色素瘤的临床与转化医学研究,以第一作者分别于J Clin Oncol、Clin Cancer Res、Eur J Cancer等期刊发表多篇SCI文章





 京公网安备 11010502033352号
京公网安备 11010502033352号