编者按:第20期“诺华NET之声”,为读者精选了神经内分泌肿瘤(NET)领域新近发表的6项研究,涵盖生长抑素类似物治疗Ki 67 ≥10% 胰腺NET的研究,由上海市内分泌代谢病临床医学中心和瑞金医院胰腺疾病临床中心发表的ACTH分泌型胰腺NET的临床和分子特征的研究,还有1型多发性内分泌腺瘤(MEN 1)相关胰腺NET的预后,生长抑素受体显像阴性NET的预后、MRI鉴别神经内分泌肿瘤肝转移的起源等研究。本期栏目还特邀北京大学肿瘤医院李洁教授和上海交通大学医学院附属瑞金医院金佳斌教授分别对前两项研究进行点评。

1. 生长抑素类似物治疗胰腺神经内分泌瘤:Ki-67≥10%时是否有获益?
SOMATOSTATIN ANALOGS FOR PANCREATIC NEUROENDOCRINE TUMORS: ANY BENEFIT WHEN KI-67 IS ≥10%?
Oncologist [IF=5.025]
发表在《The Oncologist》的一项回顾性、多中心研究,旨在评估Ki-67≥10%的晚期、非功能性、分化良好的胰腺神经内分泌瘤(panNET)患者在真实世界中接受一线长效SSA治疗的临床结局。
该研究回顾性分析2014-2018年在NET CONNECT网络的10个中心接受治疗的panNET患者。主要终点为至下次治疗时间(TNT)和无进展生存期(PFS),次要终点为总生存期(OS)和安全性。
共纳入73例患者(G2 68例,G3 5例),其中61例(84%)存在肝转移。中位随访时间为36.4个月(范围:6-173个月),中位TNT和PFS分别为14.2个月(95%CI:11.6~16.2个月)和11.9个月(95%CI:8.6~14.1个月)。根据使用的生长抑素类似物(奥曲肽 vs 兰瑞肽),未观察到统计学上的显著差异,而肿瘤分级(HR 4.4,95%CI:1.2~16.6;P=0.04)和肝肿瘤负荷(HR 2.0,95%CI:1~4;P=0.03)的增加与PFS缩短独立相关。中位OS为86个月(95%CI:56.8~86),当肝肿瘤负荷>25%时,预后较差(HR 3.4,95%CI:1.2~10;P=0.01)。14例例患者报道了治疗相关的不良事件(AE),最常见的是腹泻。
综上,当Ki-67≥10%时,SSA对PanNETs具有抗增殖活性,尤其是对G2肿瘤,以及肝肿瘤负荷≤25%的患者。
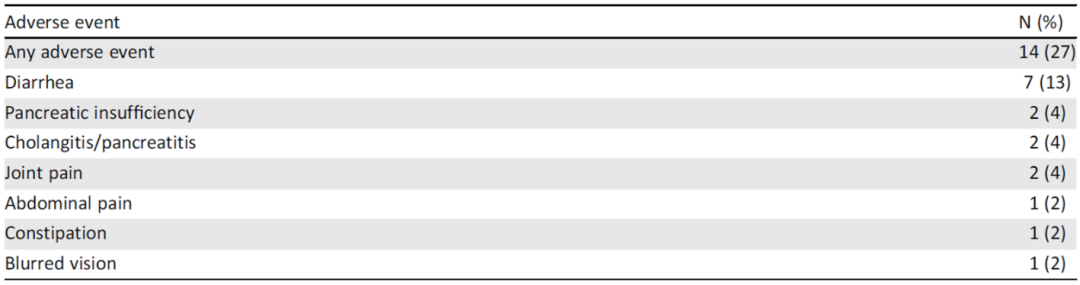

图1. Kaplan-Meier生存分析:(A) 至下次治疗时间,(B)无进展生存期
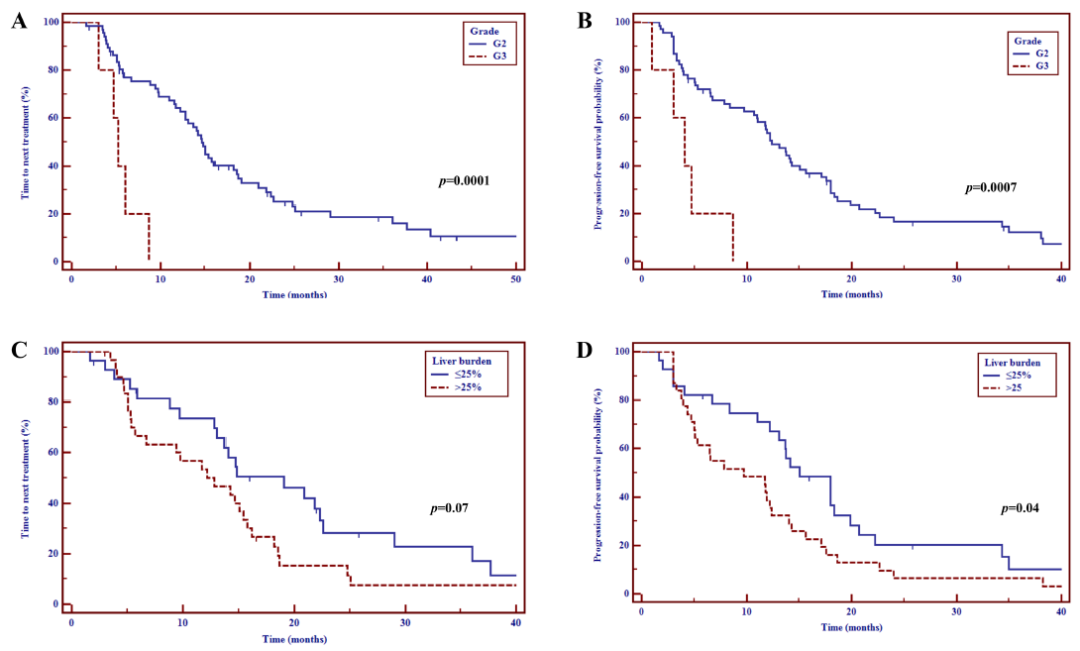
图2. Kaplan-Meier生存分析:肿瘤分级(A-B)和肝肿瘤负荷(C-D)对TNT和PFS的影响
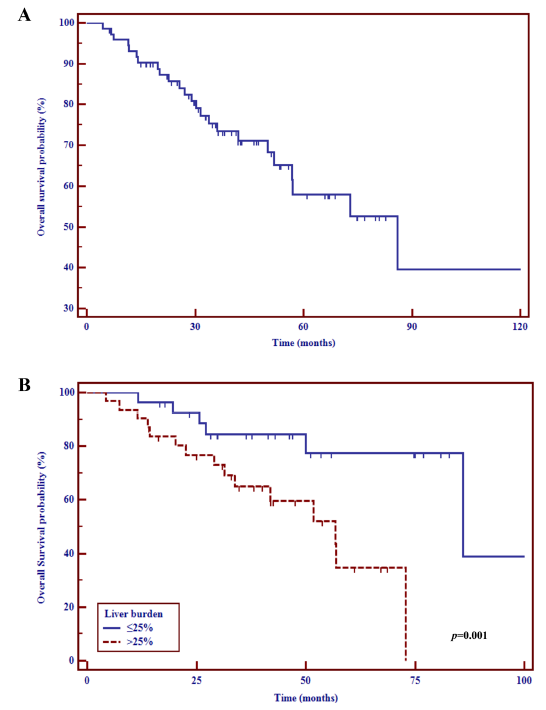
图3. 总生存期Kaplan-Meier生存分析: (A)总人群,(B)肝脏肿瘤负荷≤25% vs >25
生长抑素类似物(SSAs)是分化好的晚期或转移性胃肠胰神经内分泌肿瘤(GEP-NETs)的主要一线治疗药物。在PROMID研究中,入组患者的95%为Ki67<2%,而在CLARINET研究中,纳入的受试者均为Ki67<10%,因此,目前欧美指南推荐SSAs用于Ki67<10%的NETs。临床实践中采用SSAs治疗分化好的G1、G2(包括Ki67>10%)患者,但SSAs对Ki67≥10%的NETs的疗效缺乏研究数据。
发表在《The Oncologist》上的这个回顾性真实世界研究,纳入2014-2018年10家中心的数据,要求均为分化好的、无功能的、Ki67≥10%的、来源于胰腺的晚期神经内分泌肿瘤(panNETs)患者,接受SSAs一线治疗。主要研究终点是至下一种治疗的时间(time to next treatment,TNT)和无进展生存时间(PFS),次要研究终点为总生存时间(OS)和安全性。共纳入73例患者,按照WHO 2019病理分级标准,68例G2,5例G3;52例(71%)Ki67≤15%,61例有肝转移(84%)。该研究结果表明G2比G3患者的中位TNT、PFS和OS均有明显延长,肝转移负荷大者(>25%)生存期明显缩短。研究还发现,从确诊panNETs至发生转移的时间超过12个月的患者,其TNT和PFS较未超过12个月的患者有明显延长。
这个回顾性研究告诉我们,SSAs可以用于Ki67≥10%的G2 panNETs患者,但对于G3患者疗效有限,需要慎用。另外,对于肿瘤负荷较小者及进展相对缓慢者获益更多。由于是回顾性研究且样本量偏小,不可避免的会存在偏倚而影响研究结果,所以临床实践中需要综合评估患者的状况来考虑治疗方案。
2. ACTH分泌型胰腺神经内分泌肿瘤的临床特点及分子机制
The Clinical Features and Molecular Mechanisms of ACTH-secreting Pancreatic Neuroendocrine Tumors
J Clin Endocrinol Metab [IF= 5.399]
发表在《J Clin Endocrinol Metab》的一项单中心研究,旨在通过甲基化分析来阐明具有异位ACTH(EAS)的胰腺神经内分泌肿瘤(pNETs)的临床特征和分子机制。
?
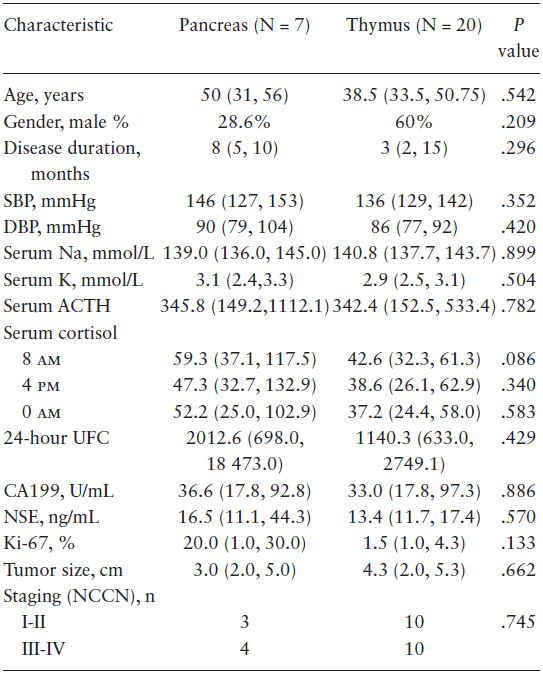
研究纳入2001年-2019年间在上海市内分泌代谢病临床医学中心和瑞金医院胰腺疾病临床中心确诊的7例异位ACTH分泌型pNET患者。20例异位分泌ACTH的胸腺神经内分泌肿瘤(TNETs)患者和7例非功能性胰腺神经内分泌肿瘤(nf-pNETs)患者作为对照。收集临床资料并测量POMC启动子CpG甲基化。
7例患者胰腺ACTH染色阳性,ACTH和尿游离皮质醇(UFC)水平升高,诊断为异位分泌ACTH的pNET。7例患者中6例接受手术,1例接受经动脉栓塞术(TAE)。术后无病患者2例;术后90天内死亡患者2例;1年内疾病转移并死亡的患者3例。ACTH分泌型pNETs与ACTH分泌型TNETs的临床和生化特征相似,但前者预后较差。ACTH分泌型pNETs的前体阿黑皮素原(POMC)启动子CpG甲基化显著低于非功能性胰腺神经内分泌肿瘤和正常胰腺。
综上,ACTH分泌型pNET具有侵袭性和致命性,对于无转移且可切除的原发性肿瘤患者,手术是明确的根治性手段。POMC启动子低甲基化导致pNET产生ACTH。本研究进一步补充了胰腺异位ACTH综合征的基因特征。
表2. ACTH分泌型pNET和TNET患者的临床特征
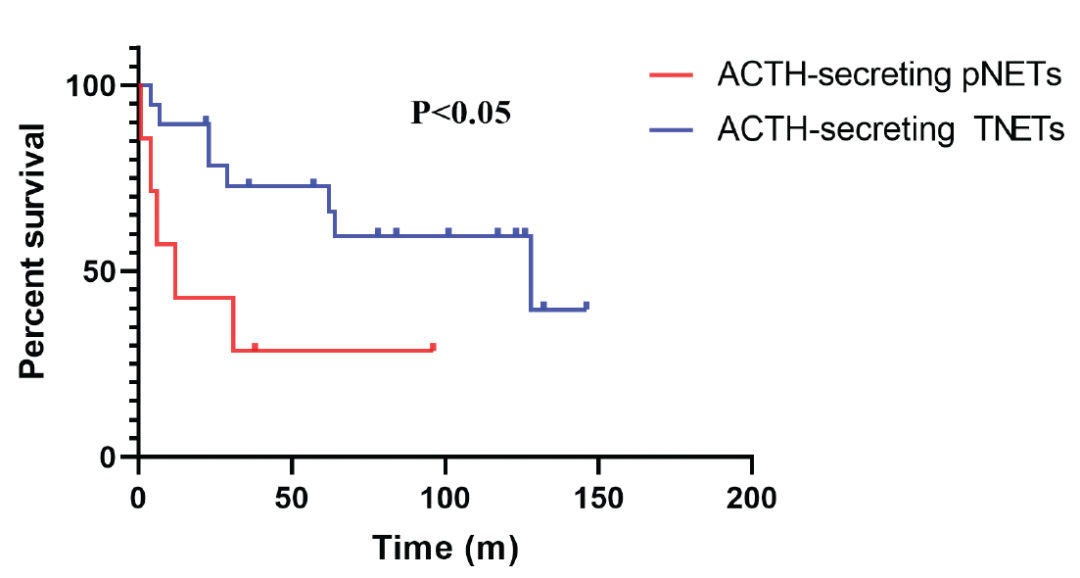
注:pNETs和TNETs的1年生存率分别为42.9%和89.5%;5年生存率分别为28.6%和72.7%图4. 总生存曲线:ACTH分泌型pNET vs ACTH分泌型TNET
图5. ACTH分泌型TNETs、ACTH分泌型pNETs、nf-pNETs和胰腺中POMC启动子区Ⅳ区甲基化
异位ACTH综合征(EAS)占ACTH依赖性库欣综合征的20%,约占所有类型库欣综合征的10%。EAS与多种恶性肿瘤相关,主要来源于神经内分泌肿瘤。神经内分泌肿瘤是起源于肽能神经元和神经内分泌细胞的一系列异质性肿瘤。神经内分泌肿瘤流行病学统计显示胃肠胰NETs的年发病率约为3.56/10万(其中pNETs为0.48/10万),肺 NETs的年发病率约为1.49/10万,原发灶不明NETs的年发病率约为0.84/10万,整体神经内分泌肿瘤发病率较低,因此胰腺异位ACTH分泌综合征更为罕见。其中4%-16%的异位ACTH综合征来源于胰腺,主要由胰腺神经内分泌肿瘤引起,但对于此类疾病的预后知之甚少。
对于胰腺异位ACTH分泌综合征的治疗方法包括切除原发病灶、双侧肾上腺切除、肝转移灶经动脉栓塞(TAE)以及药物控制皮质醇增多症。但大部分患者就诊时已是局部晚期甚至远处转移,且因高皮质醇血症、严重感染从而失去手术的机会。有关文献报道显示在神经内分泌肿瘤患者当中,EAS类型的患者较无功能患者预后更差。另一方面,POMC启动子区的低甲基化在小细胞肺癌(SCLC) 、胸腺神经内分泌肿瘤(TNETs)和胰腺孤立性纤维性肿瘤中均有报道,但从未在pNETs中进行过研究。
本文旨在通过甲基化分析阐明pNETs合并EAS的临床特征和分子机制。
胰腺异位ACTH分泌综合征具有较高的转移率和死亡率,预后较差,如何控制皮质醇水平延长患者生存期尤为重要,但中国暂无降皮质醇药物上市,手术是降低皮质醇或改善库欣综合征以及可切除原发灶且无转移患者的最佳治疗方式,微创尤其具有优势。本次研究显示与无功能pNETs和正常胰腺组织相比,分泌ACTH的pNETs与POMC启动子低甲基化有关,这项研究结果可能可以作为胰腺异位ACTH分泌综合征遗传特征的补充。此项研究为目前报道胰腺异位ACTH分泌综合征的最大样本量研究,且详尽分析了每例患者的个体化治疗方法,有成功的经验,也有失败的教训,为将来开展前瞻性研究提供了更好的治疗策略和参考。
3. 激素水平作为G2小肠神经内分泌瘤的预后标志物和最佳临界值的评估
Assessment of hormonal levels as prognostic markers and of their optimal cut-offs in small intestinal neuroendocrine tumours grade 2
Endocrine [IF=3.235]
发表在《Endocrine》的一项回顾性研究,探索基线嗜铬粒蛋白A (CgA)和5-羟吲哚乙酸(5-HIAA)和对治疗的早期生化缓解的预后价值,并比较文献中使用的不同临界值。
该研究纳入184例接受生长抑素类似物(SSA)、干扰素(IFN-α)或肽受体放射性核素治疗(PRRT)的G2小肠神经内分泌肿瘤(siNET)患者。基线CgA是肿瘤特异性生存期(CSS)和无进展生存期(PFS)统计学上显著的预后指标。在大多数情况下,5×ULN(正常值上限)的临界值可以最好的区分开;但对于SSA,2×ULN可以更好的区分开。基线5-HIAA是IFN-α和PRRT治疗患者CSS的预后指标,但不是SSA单药治疗的预后指标。CgA和5-HIAA的早期变化与SSA治疗的CSS(HR 3.18,95%CI:1.82~5.56;HR 1.47,95%CI:1.16~1.86)和PFS(HR 3.08,95%CI:1.86~5.10;HR 1.37,95%CI:1.11~1.68)相关性很好,但与PRRT治疗不相关。
综上,无论接受何种治疗,基线CgA和5-HIAA均与CSS相关,与PRRT后的PFS相关,5×ULN在许多但并非全部情况中可以最好区分。CgA和5-HIAA的早期降低是SSA治疗的预后指标,但不是PRRT的预后指标。
表3. 基线CgA作为CSS和PFS的预测指标

表4. 基线5-HIAA作为CSS和PFS的预测指标
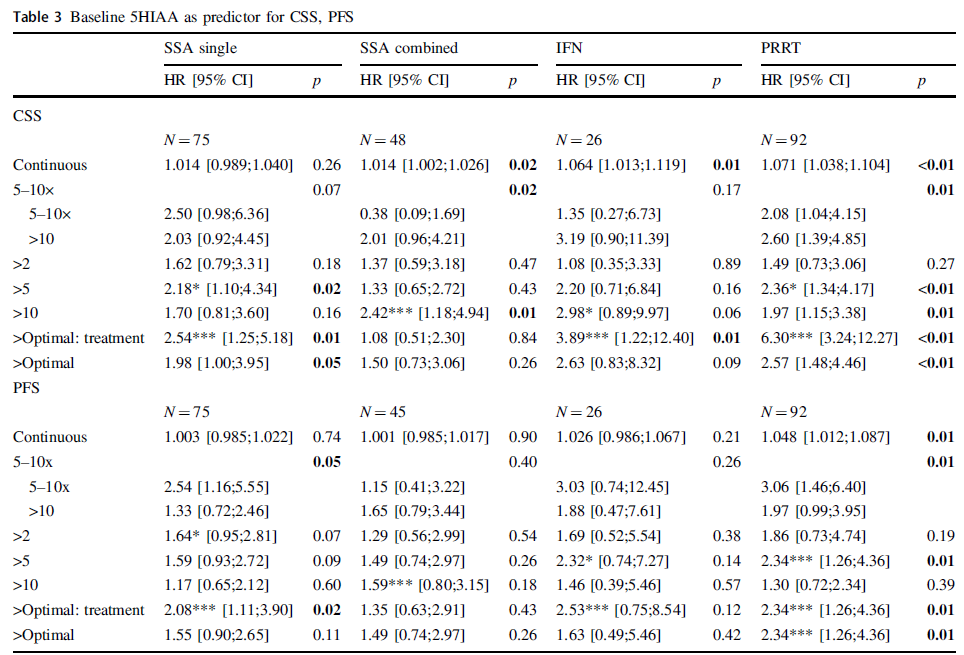
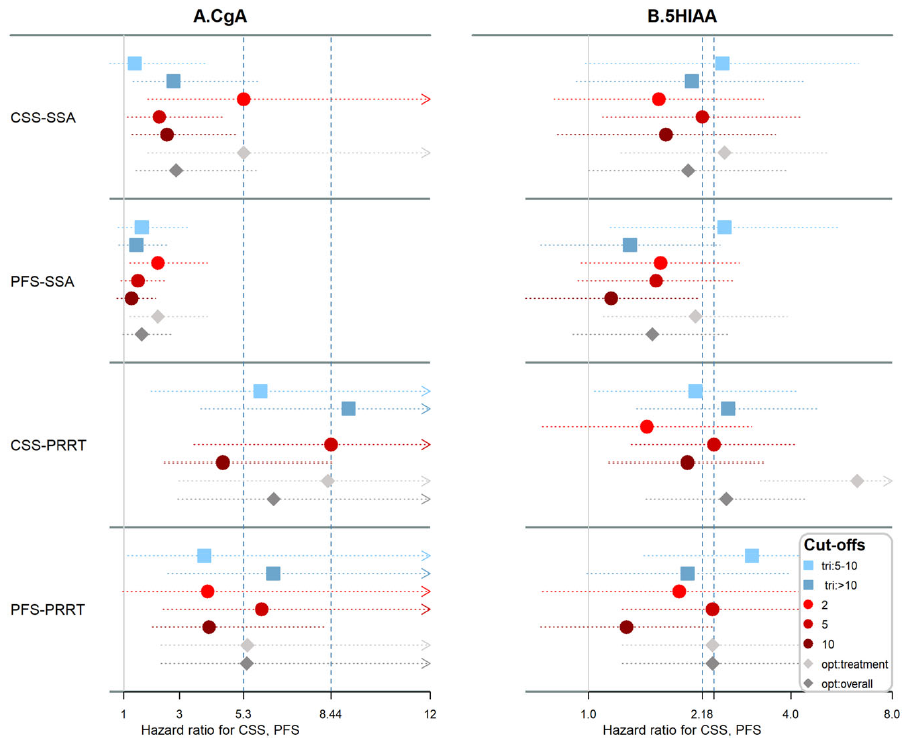
图6. 接受生长抑素类似物(SSA)或肽受体放射性核素治疗(PRRT)的不同临界值患者的肿瘤特异性生存期(CSS)和无进展生存期(PFS)。A. 嗜铬粒蛋白A(CgA);B. 5-羟基吲哚乙酸(5-HIAA)
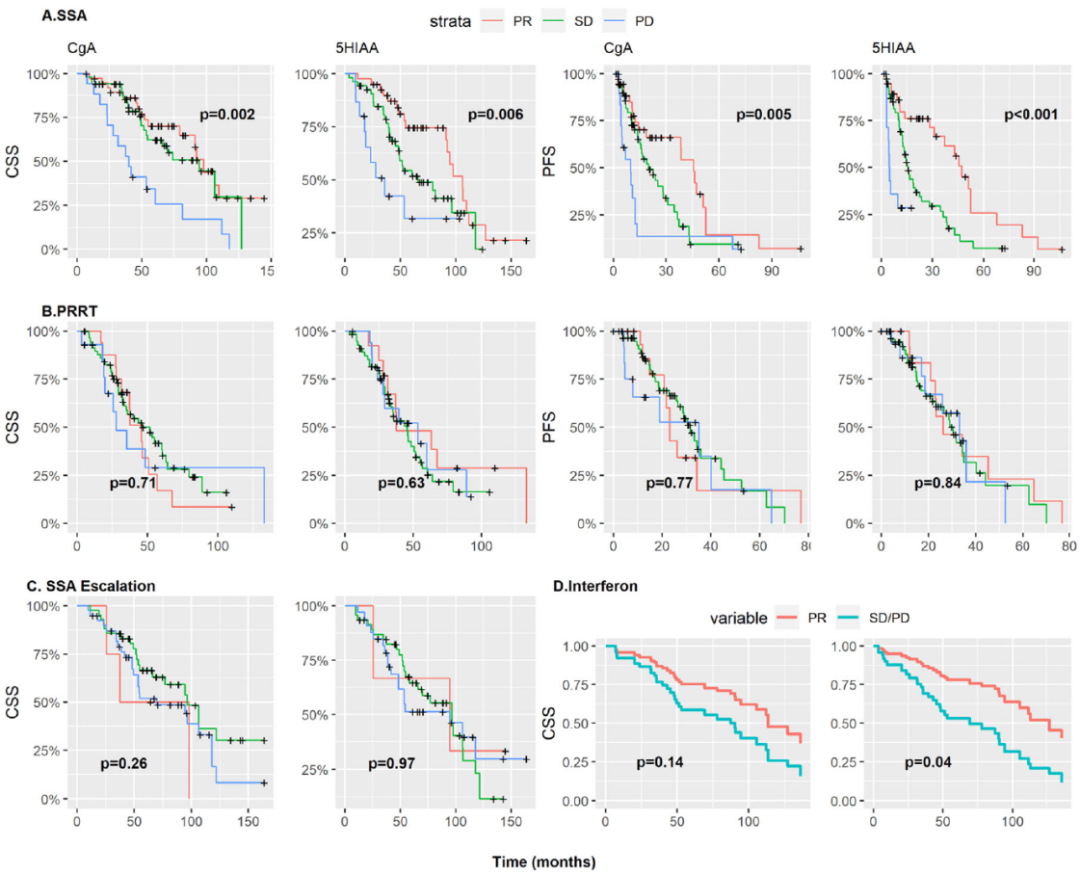
图7. 根据6个月生化缓解分层的生长抑素类似物(SSA) (A)、肽受体放射性核素治疗(PRRT) (B)和SSA剂量递增(C)治疗的肿瘤特异性生存期(CSS)和无进展生存期(PFS)。干扰素治疗患者调整后的CSS生存曲线,根据cox模型的生化缓解,根据伴用SSA治疗分层(D)
4. 1型多发性内分泌腺瘤(MEN 1)相关的胰腺神经内分泌瘤的术后预后:功能性事件
Prognosis after surgery for multiple endocrine neoplasia type 1-related pancreatic neuroendocrine tumors: Functionality matters
Surgery [IF=3.356]
发表在《Surgery》的一项观察性研究,旨在评估切除后的MEN 1相关的非功能性胰腺神经内分泌瘤患者的预后是否与切除后的MEN 1相关的胰岛瘤患者不同,并评估与预后相关的因素。
研究从两个数据库(DutchMEN Study Group和International MEN1 Insulinoma Study Group数据库)纳入1990年至2016年之间进行MEN 1相关的非功能性胰腺神经内分泌瘤切除的患者。通过Cox回归分析以评价非功能性胰腺神经内分泌瘤患者对比胰岛素瘤患者的无肝转移生存期,并确定与无肝转移生存期相关的因素。
153例MEN 1患者中,61例进行了非功能性胰腺神经内分泌瘤切除,92例进行了胰岛素瘤切除。在切除淋巴结的患者中,非功能性胰腺神经内分泌瘤患者中有56%(18/32)发生淋巴结转移,胰岛素瘤患者中有10%(4/41)发生淋巴结转移(P=0.001)。对于非功能性胰腺神经内分泌瘤患者,估计的10年无肝转移生存率(LMFS)为63%(95%CI:42%~76%),对于胰岛素瘤患者为87%(72%~91%)。在调整肿瘤大小、世界卫生组织肿瘤分级和年龄后,非功能性胰腺神经内分泌瘤患者的肝转移或死亡风险增加(HR 3.04,95CI:1.47~6.30)。在≥2 cm的胰腺神经内分泌瘤患者中,非功能性胰腺神经内分泌瘤(HR 2.99,95%CI:1.22-7.33)和世界卫生组织分级G2(HR 2.95,95%CI:1.02~8.50)与无肝转移生存期相关。
综上,切除的MEN 1相关的非功能性胰腺神经内分泌瘤患者的无肝转移生存率显著低于胰岛素瘤患者。术后咨询和随访方案应该针对肿瘤类型,至少应考虑肿瘤大小和世界卫生组织分级。
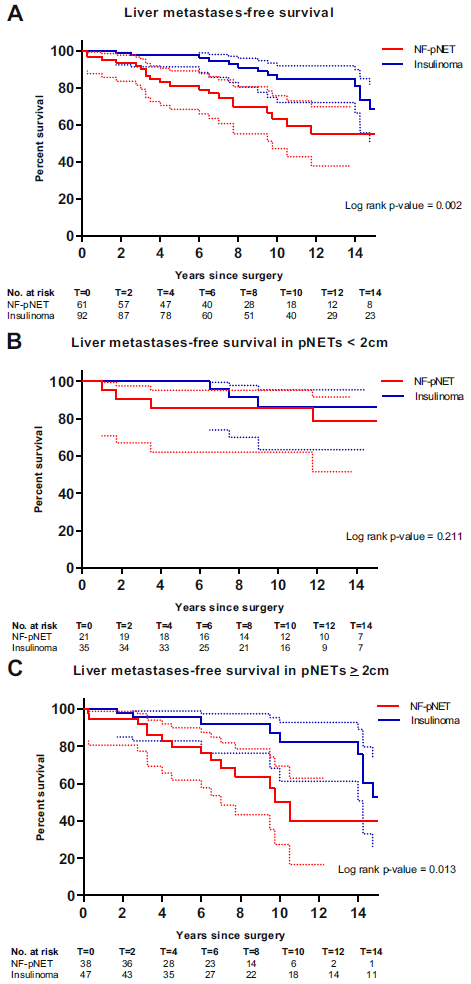
图8 (A) 切除的MEN1相关的胰腺神经内分泌瘤患者的LMFS;(B) 切除的MEN1相关的胰腺神经内分泌瘤<2 cm患者的LMFS;(C) 切除的MEN1相关的胰腺神经内分泌瘤≥2cm患者的LMFS
表4. 与肝转移或死亡相关因素的多变量分析
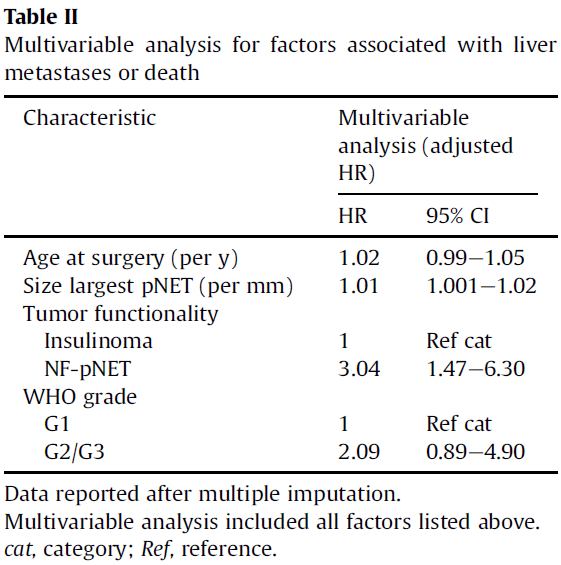
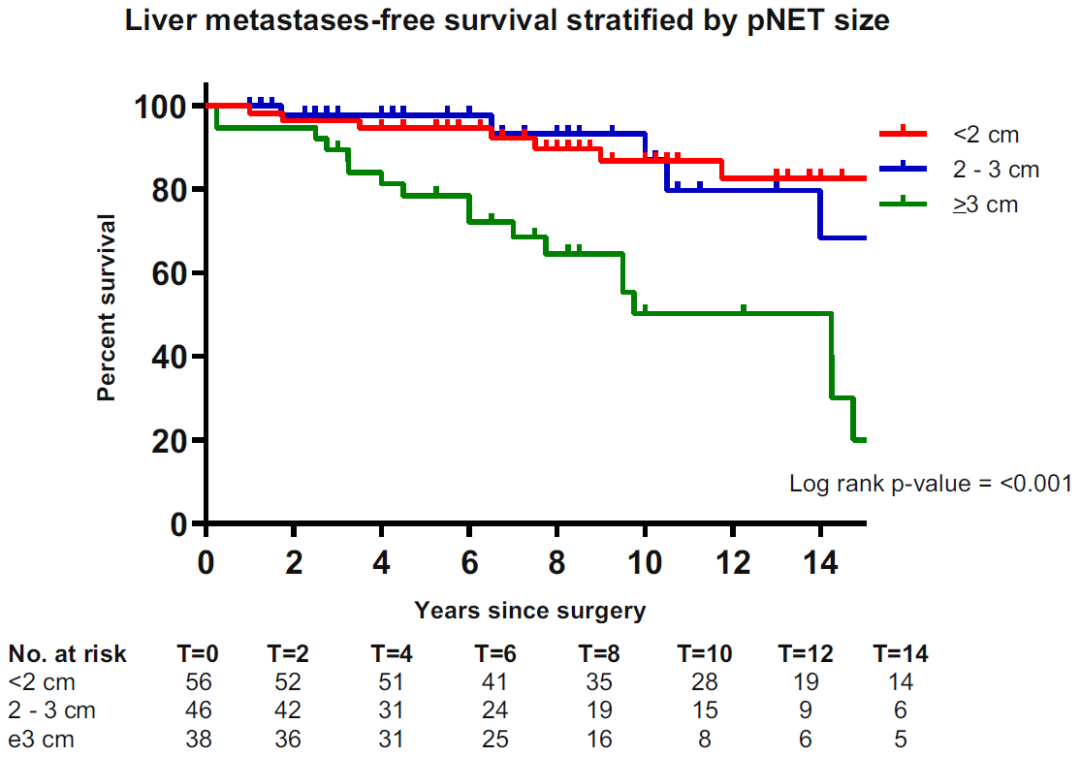
图9. 切除MEN1相关的胰腺神经内分泌瘤患者根据肿瘤大小分层的LMFS
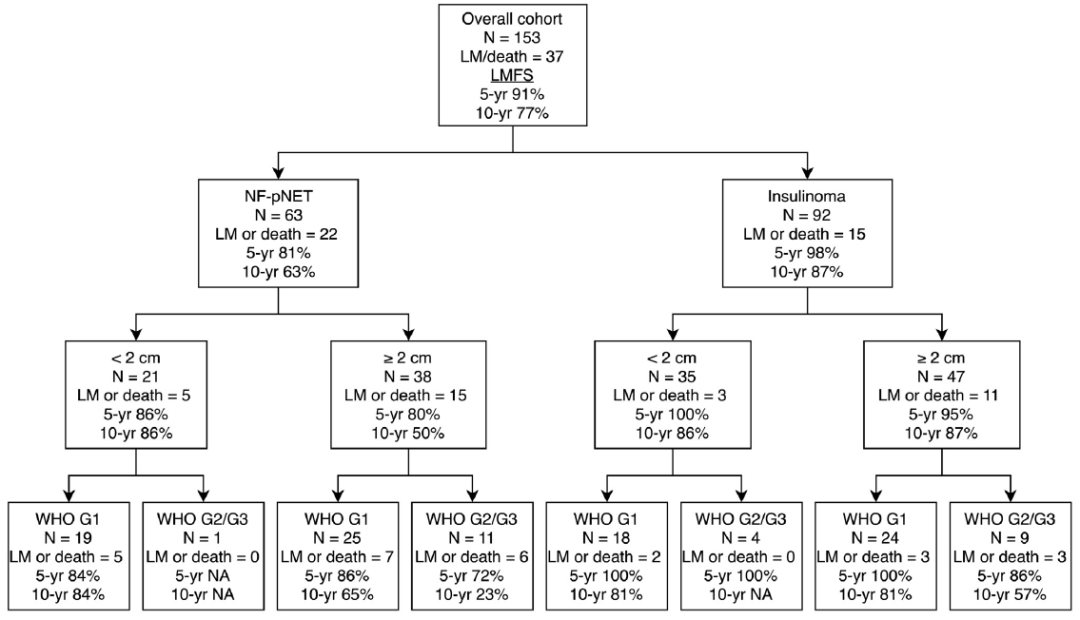
图10. 不同病理学患者的LMFS;n,患者数
5. 生长抑素受体显像阴性神经内分泌肿瘤患者的不良预后
Inferior outcome of neuroendocrine tumor patients negative on somatostatin receptor imaging
Endocr Relat Cancer [IF= 4.8]
发表在《Endocr Relat Cancer》的一项回顾性分析,旨在通过分析两个前瞻性的NET数据库中的数据,对匹配的转移性G1或G2 SSTR-阳性和阴性NET患者进行比较。
SSTR阴性定义为诊断性SSTR显像中肿瘤摄取不足。排除接受PRRT的患者。研究纳入77例SSTR阴性和248例SSTR阳性的G1-2 NET患者。SSTR阴性患者的中位总生存期显著低于SSTR阳性患者(53个月vs 131个月;P<0.001)。为了校正年龄、性别、肿瘤级别和原发部位可能造成的混淆,将69例SSTR阴性NET患者与69例SSTR阳性NET患者进行倾向性评分匹配。除了SSTR阴性的患者更常接受化疗和靶向治疗外,其他特征相似。
SSTR阴性患者与SSTR阳性患者相比,生存结果较差(中位总生存期:38个月 vs 131个月;P=0.012)。多因素Cox回归分析结果证实,高级别肿瘤或接受手术是生存结局的主要影响因素。
综上,尽管接受了更积极的治疗,倾向性评分匹配的SSTR阴性NET患者的预后仍然比SSTR阳性NET患者差。肿瘤生物学的差异可能是生存结果差异的基础。
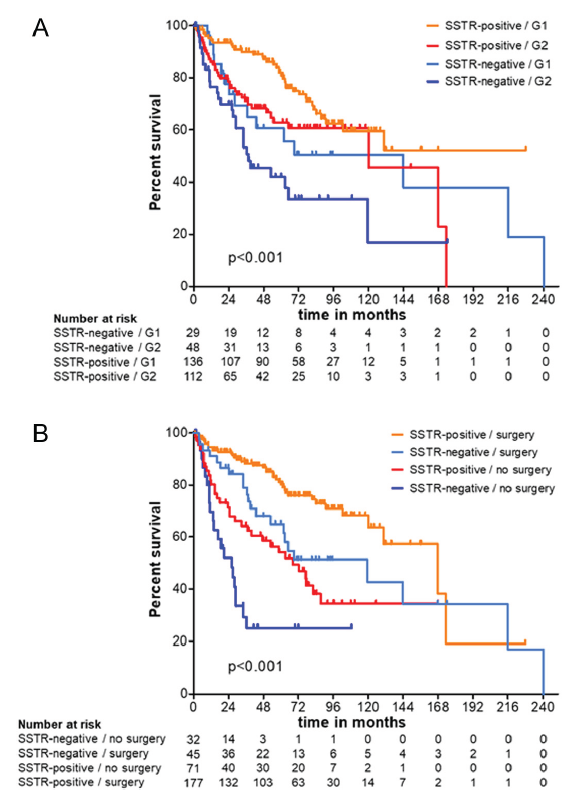
图11. Kaplan–Meier曲线:完整队列中不同协变量组的总生存期
A. SSTR状态与肿瘤分级(G1 165,G2 160);B. SSTR状态与手术干预(有 222,无 103)
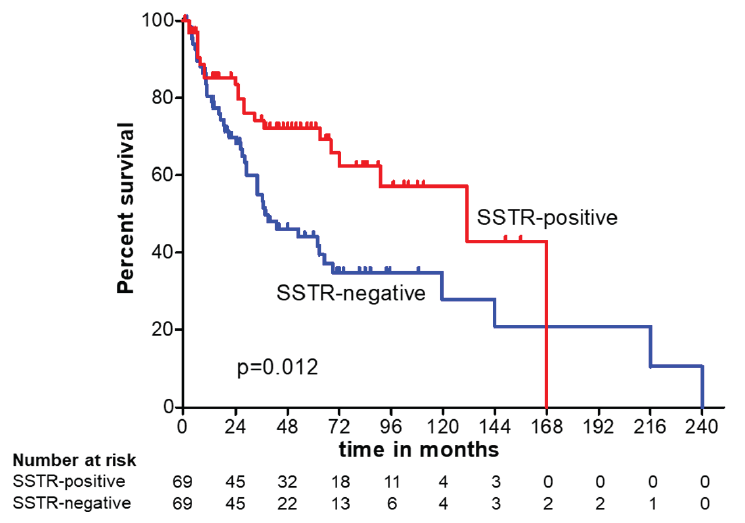
图12. Kaplan–Meier曲线:倾向评分匹配队列(阴性 vs 阳性)
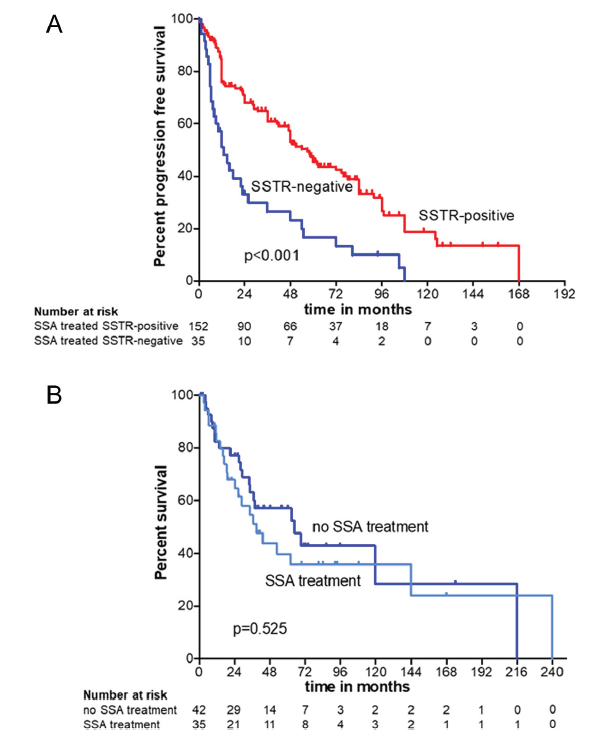
A. 不同SSTR状态患者接受SSA后的无进展生存期;B. SSTR阴性患者的总生存期(SSA vs 无SSA)
6. MRI鉴别神经内分泌肿瘤肝转移的起源
MRI to identify the origin of neuroendocrine tumor liver metastases
Neuroendocrinology [IF=4.271]
发表在《Neuroendocrinology》的一项回顾性研究,旨在应用磁共振成像(MRI)鉴别胰腺神经内分泌肿瘤(pNET)肝转移和中肠神经内分泌肿瘤(mNET)肝转移。
研究对24例pNET肝转移患者的MRI检查进行定量和定性分析,并与23例mNET肝转移患者的MRI检查结果进行比较。采用kappa和组内相关系数(ICC)计算读片者间的一致性。计算各变量对pNET肝转移诊断的敏感性、特异性和准确性。在单变量和多变量分析中评估变量和原发肿瘤(即pNET vs mNET)之间的关系。用20例pNET和20例mNET患者的外部队列进行列线图的开发和验证。
读片者之间的一致性在定性标准上为“强”(k=0.893-1),在定量标准上“卓越”(ICC:0.9817-0.9996)。在单因素分析中,T1加权图像的同质性是诊断pNET的最有鉴别价值的变量(OR 6.417;P=0.013),其敏感性最高(88%,21/24;95%CI:68%~97%)。多变量分析显示,T1加权图像上的肿瘤同质性(OR 17.607;95%CI:2.179~142.295;P=0.007)和DW图像上的靶环征(OR 19.869;95%CI:2.305~171.276;P=0.007)与pNET独立相关。列线图显示训练组pNET诊断的校正AUC为0.894(95%CI:0.796~0.992),验证组为0.805(95%CI:0.662~0.948)。
综上,MRI可呈现定性特征,有助于区分pNET肝转移和mNET肝转移。
表5. 存在肝转移的24例pNET vs 22例mNET分类标准的MRI表现
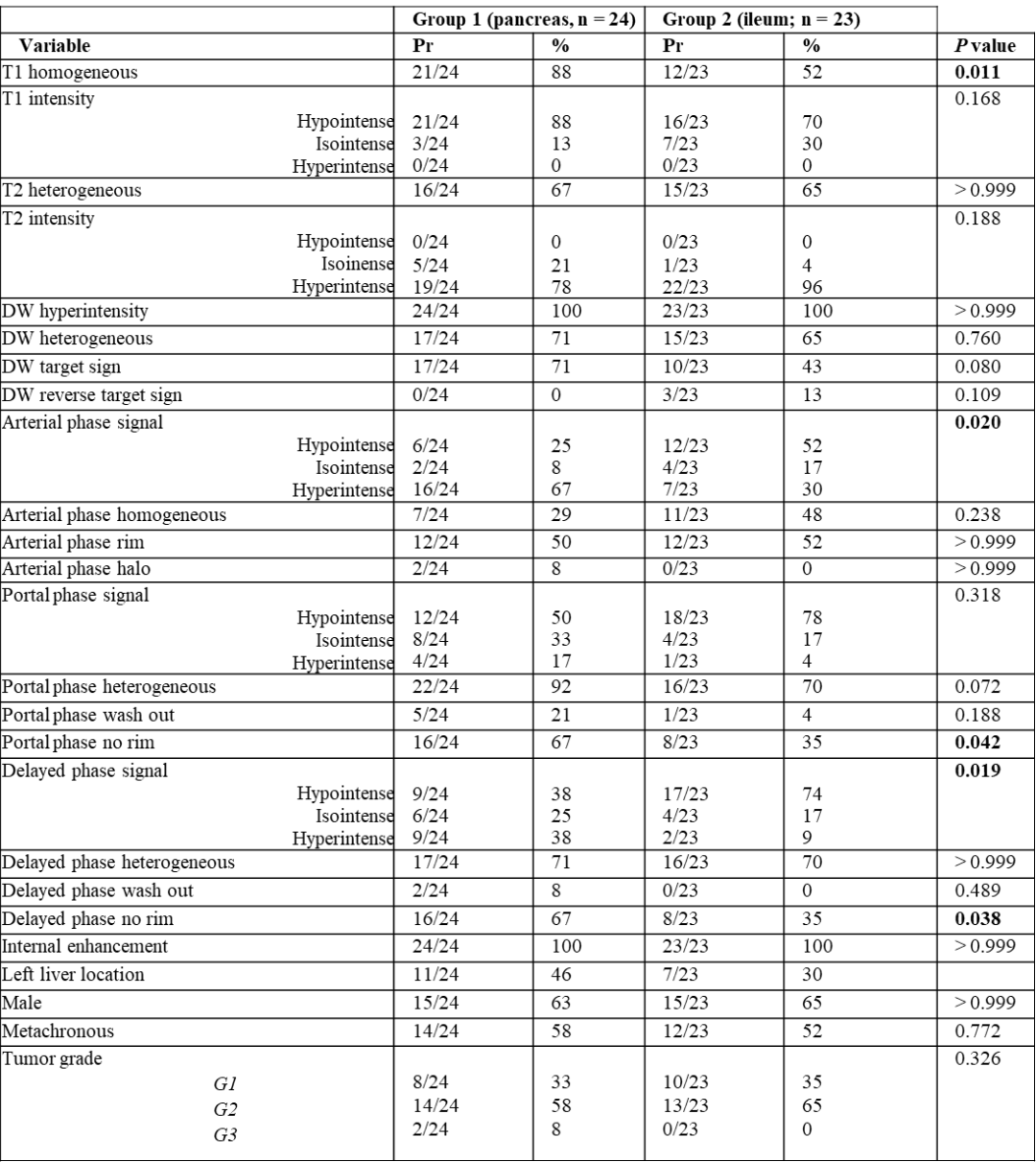
表6. 训练队列中MRI诊断pNET肝转移的敏感性、特异性和准确性
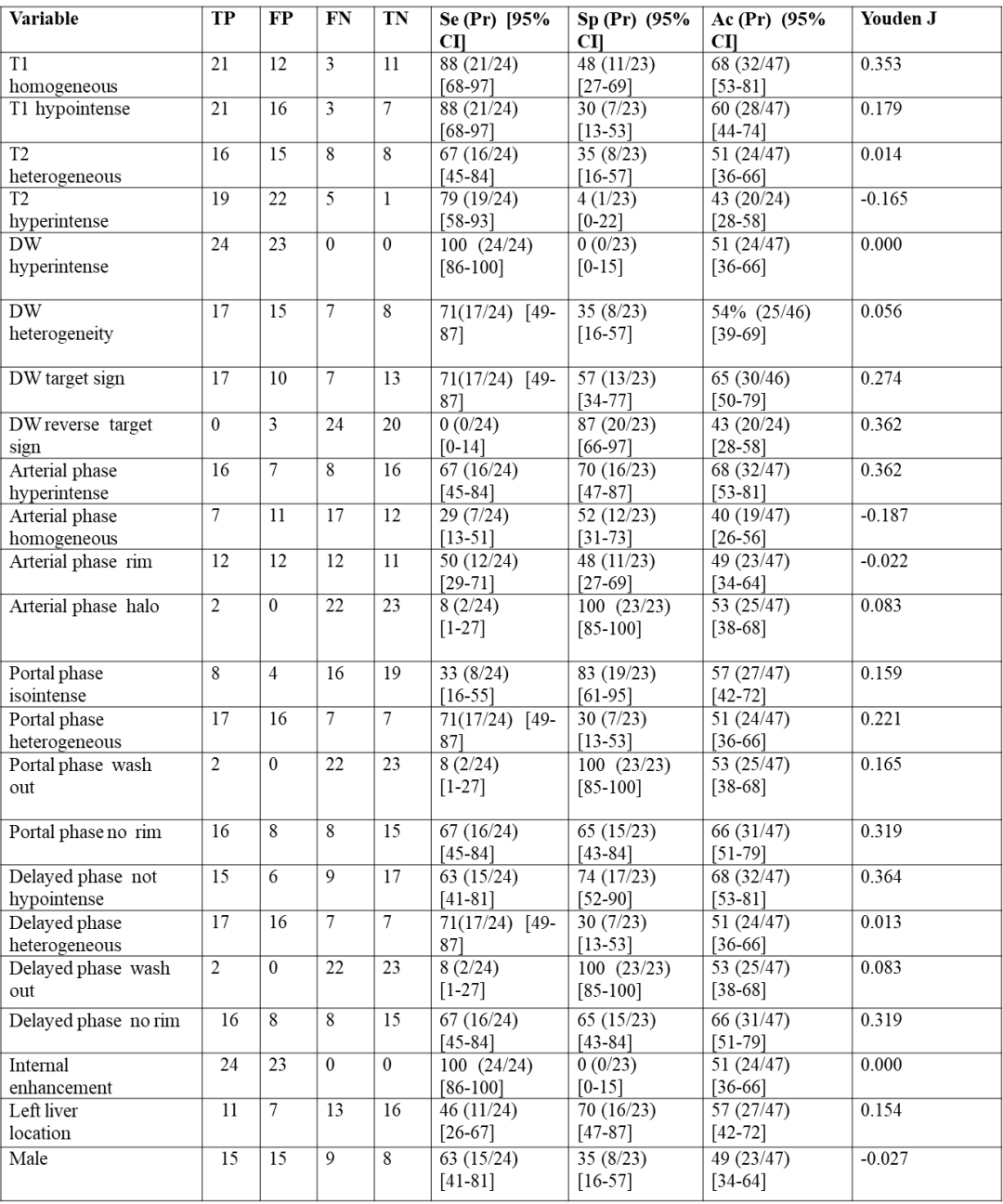
表7. 采用条件logistic回归模型对47例训练队列(诊断为“胰腺原发性”)患者进行单变量分析,评价独立MRI表现与肝转移实际起源之间的相关性
Net21011747
北京大学肿瘤医院消化肿瘤内科主任医师
中国老年学学会老年肿瘤专业委员会胃肠分委会常委
中国女医师协会临床肿瘤学专业委员会常委
中国临床肿瘤学会胃肠神经内分泌瘤专家委员会委员
中国医疗保健国际交流促进会第二届神经内分泌肿瘤分会常委
中华医学会消化病学分会胃肠激素及NET学组委员
中国医师协会胰腺病学专委会胰腺神经内分泌肿瘤专业委员会委员
北京医学会消化病学分会第九届委员会委员
博士,上海交通大学医学院附属瑞金医院普外科胰腺外科副主任医师
中国医师协会外科医师分会机器人外科医师学组青年委员
上海市医学会普外科专科分会减重与代谢学组副组长
中国医师协会外科医师分会肥胖和糖尿病外科医师委员会青年委员会委员
中国医疗保健国际交流促进会神经内分泌肿瘤分会青委委员
中国医药教育协会代谢病学专业委员会委员
中国研究型医院学会智能医学专业委员会委员
“中国普通外科青年学者攀登计划”成员
胰腺青年精英俱乐部成员





 京公网安备 11010502033352号
京公网安备 11010502033352号