编者按:第62届美国血液学会(ASH)年会正以线上的形式举行,《肿瘤瞭望》特推出“ASH 5分钟”特别栏目,四位大咖联袂担任每日新闻播报员,纵览全天内容,精选最热点、最重磅、最有趣的研究,5分钟即可get最新热点。12月5日ASH热点内容CAR-T技术在B细胞淋巴瘤中的新突破将由中山大学肿瘤防治中心李志铭教授分享。

一、#400.人源性CD20×CD3双特异性抗体奥尼妥单抗(REGN1979),可诱导高度难治性B细胞非霍奇金淋巴瘤患者(包括对嵌合抗原受体T细胞疗法(CAR-T)治疗无效的患者)产生持久的、完全的反应。
该研究旨在评估REGN1979,一种铰链稳定的、完全基于人IgG4的CD3×CD20双特异性抗体(bsAb)用于复发/难治性(R/R)B细胞非霍奇金淋巴瘤(B-NHL)患者的疗效情况。
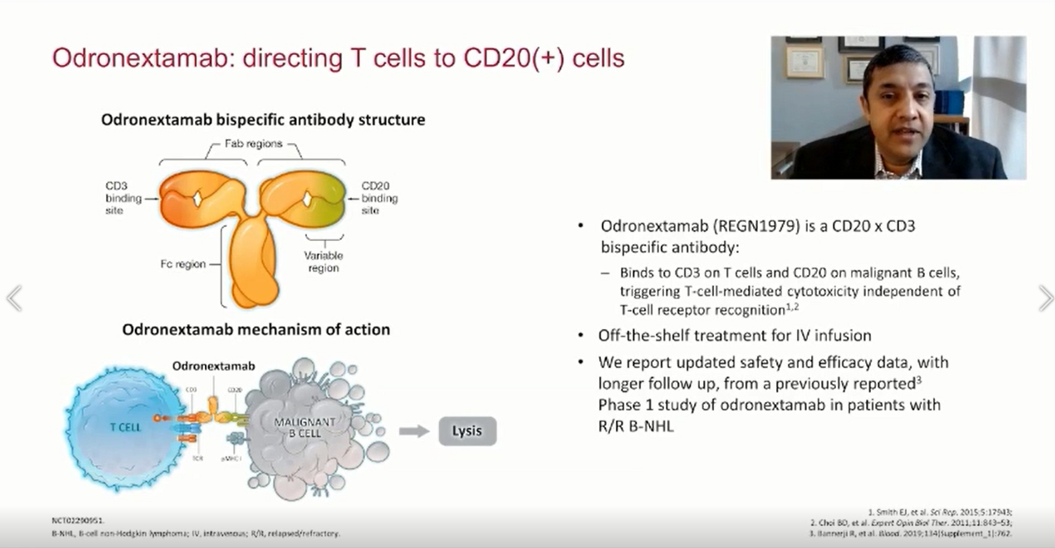
采用递增剂量方案给予Odronextamab (REGN1979),第1周给予初始剂量,第2周给予中剂量,此后,每周固定剂量,直至第12周,然后维持每2周给药一次的剂量。预防性使用地塞米松以降低细胞因子释放综合征(CRS)的风险。

共纳入127例复发/难治性B细胞非霍奇金淋巴瘤患者接受了0.03-320 mg剂量的治疗。
①有效性方面:80.3%患者是为复发难治性患者,并曾接受过中位数为3种的(范围:1-11)治疗;85个患者(66.9%)对烷化剂和抗CD20抗体双重耐药。中位随访时间为3.9个月(0.4-37.6)个月。ORR:90%(N=27/30),CR率:70(N=21/30)。且中位完全缓解时间尚未达到。
②安全性方面:在剂量递增过程中,剂量限制性毒性未见报告,且Odronextamab (REGN1979)剂量达每周320 mg时未达到最大耐受剂量。
REGN1979对高度难治性B细胞非霍奇金淋巴瘤患者具有良好的抗肿瘤活性。包括对CAR-T治疗无效的患者均观察到持久性严格的完全缓解(CRs)。大多数CRs在数据截止(data cutoff)时依旧维持。
这一研究采用了完全人源化的特异性抗体REGN1979,其靶向目前较为常见的CD3与CD20,这类研究靶点还包括CD3与CD19。这一研究亮点在于其入组了接受CAR-T治疗失败的患者,标准化的CAR-T产品已获得FDA批准并在美国上市,不过临床治疗过程中部分患者接受CAR-T治疗后仍有进展,关于失败后的治疗方案目前业内并没有标准,可以说这一研究很好地提供了治疗方向。既往许多CAR-T药物大多以一个靶点为主,容易导致耐药。REGN1979可以同时靶向B细胞和T细胞从而增强了T细胞的攻击能力和识别性。从数据来看,对弥漫大B淋巴瘤和滤泡性淋巴瘤患者效果显著。在安全性方面,研究人员采用输注地塞米松和逐步剂量递增的给药方案后CRS等不良反应均有所改善,总体来说对于临床上特别顽固的、复发难治的患者,尤其是接受过CAR-T治疗失败的人群的治疗有了新方向。
二、#404.一种新型靶向串联嵌合抗原受体CD20和CD19的MB-CART2019.1治疗复发性或难治性B细胞非霍奇金淋巴瘤患者的I期试验
旨在评估通过剂量限制毒性(MTD)的研究确定MB-CART2019.1在CD20和CD19+ 的R/R B-NHL成年患者中的最大剂量限制毒性(DLT)。

研究为6 + 3试验设计,主要有两个预定评估剂量水平。主要评估其药效学,包括CAR-T细胞的最大浓度(Cmax),峰扩展时间(tmax),AUC(d0至d28)和持久性。研究计划在白细胞分离后14天输注(第0天)新鲜的MB-CART2019.1。从研究前第-5天到第-3天进行氟达拉滨/环磷酰胺淋巴结清髓化疗。

共纳入12名患者,每个剂量水平6名患者,中位年龄为72岁(范围为20、78岁),其中10例> 65岁,8例> 70岁。5例患者在进入研究时属于难治性淋巴瘤,其中7例患者的IPI≥3。
①安全性方面:没有观察到DLT,也没有观察到细胞因子释放综合征(CRS)或神经毒性等级≥3。分别在DL1和DL2的3/6患者中发生CRS 1级,在DL2的2例患者中发生CRS 2级。1例患者接受了Tocilizumab的治疗。DL2的1名患者发生1级神经毒性。上述CRS和神经毒性完全消失。
②有效性方面:直到数据截止,在12/12患者中观察到MB-CART2019.1持续存在。9/12例患者(ORR 75%)对MB / CART2019.1治疗获得反应,其中获得CR病例数为5/12。在DL1队列中, 3/6患者中有反应(ORR 50%),在DL2 队列中,6/6患者中有反应(ORR 100%)。从药代动力学学显示T细胞水平的参数与临床之间有相关性。5/9患者持续获得反应,其中最长的反应持续时间为330天。
从研究数据来看,其应用的可行性和安全性非常好。随着串联的CAR-T细胞的持续扩增,同时伴随其临床疗效:
这一研究才用了CD19和CD20进行串联治疗,这一序贯治疗方法也是目前临床研究方向之一。同前文一样,无论是单CD19或者CD20的CAR-T治疗都有耐药问题。同时在此项I期研究中未发现有最大剂量限制毒性(DLT),同时也未观察到3级以上CRS。两种抗原的串联治疗从初步临床结果来看效果显著,期待后续的II期研究的开展。
三、#405.ZUMA-12中期分析:Axicabtagene Ciloleucel(Axi-Cel)一线治疗高危大B细胞淋巴瘤(LBCL)患者(Pts)Phase II研究
根据ZUMA-1结果来看,针对≥2线以上系统治疗后 R / R LBCL成人治疗效果显著。因此研究人员进行了ZUMA-12研究,旨在探究高风险LBCL的患者一线接受抗CD19嵌合抗原受体(CAR)T细胞疗法Axicel的疗效、安全性和药代动力学(PK)结果。
根据入组条件,共有31例患者,对其中对15例接受了≥3个月的axi-cel治疗的患者进行中期分析。
①有效性方面:在12个可评估反应的患者中,研究者评估的ORR为92%(95%CI,62%– 100%),CR率为75%(95 %CI,43%-95%);75%的患者在数据截止时维持持续的反应。
②安全性方面:15例可进行安全性评估的患者中,有80%经历了3级以上AE。最常见的≥3级不良事件(≥25%)是白细胞计数下降(40%),贫血(27%)和脑病(27%)。≥3级细胞因子释放综合征(CRS)和神经系统事件(NEs)分别发生在20%和27%的患者中。任何级别的所有CRS和10/11 NE均得到解决,没有发生5级不良事件。
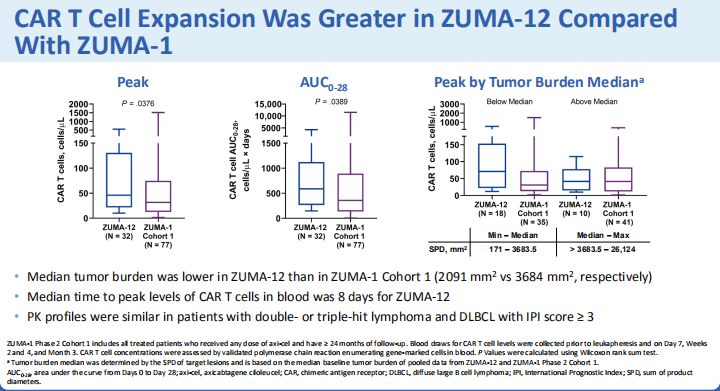 ?
?
ZUMA-12是第一个将CAR T细胞疗法作为高危LBCL的一线疗法的研究,且Axicel治疗该类患者具有明显的临床获益,ORR和CR率高,安全性可控。
本研究也是年度重磅的研究之一,既往ZUMA系列研究都以复发、难治的性患者为入组标准,而本次ZUMA-12研究,开创性的以一线高危的弥漫大B患者开展了临床研究,对于弥漫大B淋巴瘤患者来说,常规接受R-CHOP等方案后仍有30-40%的患者不能达到完全缓解,而此项ZUMA-12的中期分析,达成了诸多研究人员在国际会议上提出的建议,把理论思转化为临床实践。开创性的将用于后线治疗的产品用于了一线未经治疗的患者。从结果来看,总体有效率为92%。75%的患者有持续反应,而CRS和神经系统事件(NEs)的分别发生在20%和27%,效果还是比较显著,安全性尚可。因此后续如何处理好毒性和不良反应,让接受一线治疗的患者一开始就选对的免疫药物就特别重要。希望在以后的研究对于安全性方面的数据能够进一步提升。虽然ZUMA-12只是中期分析,但这一研究结果点燃研究人员在CAR-T一线治疗中的热情。





 京公网安备 11010502033352号
京公网安备 11010502033352号